Tinjauan Pustaka
Hidrolisis Protein
Hidrolisis
protein adalah proses pemecahan protein menjadi asam amino melalui pemecahan
ikatan peptida. Proses ini dapat terjadi secara alami melalui reaksi dengan air
atau melalui aksi enzim hidrolitik. Hidrolisis protein dengan air melibatkan
reaksi kimia di mana air bereaksi dengan ikatan peptida dalam protein,
menyebabkan pemecahan ikatan dan pembentukan rantai peptida yang lebih kecil.
Sementara itu, hidrolisis protein melalui enzim hidrolitik melibatkan
enzim-enzim seperti protease yang secara spesifik memecah ikatan peptida dalam
protein. Hasil hidrolisis protein adalah asam amino, yang penting dalam proses
pencernaan, penyerapan nutrisi, serta pembentukan dan pemeliharaan jaringan
tubuh.
Ada
tiga metode yang umum digunakan dalam proses hidrolisis. Hidrolisis asam, hidrolisis basa dan
hidrolisis enzimatik.
Hidrolisis
Asam
Asam
sulfat dan asam klorida paling sering digunakan dalam hidrolisis asam
parsial; asam asetat juga
digunakan. Asam pekat atau asam yang
diencerkan juga dapat digunakan; dibutuhkan
waktu yang lebih singkat untuk mencapai tingkat hidrolisis yang sama dengan
asam yang lebih pekat (English dan Grulke, 1934, Light, 1967). Waktu hidrolisis
juga berkurang jika reaksinya dilakukan pada temperatur tinggi. Misalnya, jika hidrolisis dilakukan
menggunakan asam klorida dengan normalitas 5.7N pada suhu 37°C, diperlukan
waktu 3 hari untuk menghidrolisis.
Sebaliknya, menggunakan asam klorida dengan konsentrasi yang sama, tetapi suhu yang
digunakan 100°C, waktu hidrolisis dipersingkat menjadi 20-30 menit (Light, 1967, Ricks et al., 1977).
Pemilihan
kondisi reaksi uhidrolisis asam sangat tergantung pada bahan baku. Jika hidrolisat akan digunakan dalam makanan,
kandungan protein dan rasa sangat penting, sehingga hidrolisis mungkin tidak
sekuat atau sepanjang itu. (Prendergast, 1974).
Hidrolisis asam juga dapat digunakan untuk menentukan kandungan protein
dalam makanan; dalam hal ini hidrolisis dilakukan sampai selesai, menggunakan
asam klorida Hidrolisis juga dapat digunakan untuk menentukan kandungan protein
dalam makanan; dalam hal ini hidrolisis dilakukan sampai selesai, menggunakan 6N
asam klorida pada suhu 137°C dan untuk jangka waktu bervariasi antara 12 hingga
96 jam. pada suhu 137°C dan untuk jangka waktu bervariasi antara 12 hingga 96
jam Davies dan Thomas, 1973). Untuk penggunaan dalam makanan, biaya hidrolisis
harus relatif rendah dan hidrolisat harus menghasilkan rasa yang meningkatkan
atau memperkuat rasa alami. Prendergast (1974) melaporkan bahwa asam sulfat
menghasilkan produk bebas garam tetapi dengan rasa yang agak keras. Selain itu,
volume besar kalsium sulfat harus disaring setelah netralisasi, yang
menghasilkan rendemen rendah dan produk yang relatif mahal. Oleh karena itu,
asam sulfat umumnya digunakan terutama dalam produksi produk makanan khusus dan
suplemen. Asam klorida umumnya lebih disukai, tetapi hidrolisat selalu
mengandung natrium atau kalium klorida, yang terbentuk saat asam-asam tersebut
dinetralkan.
Hidrolisis
Basa
Hidrolisis
alkali tidak menghasilkan rasa yang enak, tetapi dapat digunakan untuk analisis
untuk menentukan kandungan asam amino. Beberapa asam amino seperti sistein dan
arginin sepenuhnya hancur. Triptofan, yang dihancurkan oleh hidrolisis asam
total, dapat sepenuhnya dipulihkan oleh hidrolisis alkali total (Andrews dan
Baldar, 1985).
Hidrolisis
total dilakukan menggunakan natrium hidroksida 4,2N atau hidroksida barium;
waktu hidrolisis tergantung pada asam amino yang diminati. Pemulihan rendah
dari semua asam amino, kecuali triptofan, diamati untuk waktu hidrolisis antara
1 hingga 10 jam. Jika hidrolisis dilanjutkan selama 16 jam, pemulihan sebesar
85-90% dari sistein, tirosin, dan glutamin, serta pemulihan sebesar 95-100%
dari prolin, valin, leusin, dan triptofan
(Davies dan Thomas, 1973).
Hidrolisis
Enzimatik
Hidrolisis
enzimatik umumnya lambat, cukup mahal, dan jarang dilakukan sampai selesai.
Protein alami memiliki struktur berbentuk globular dan ikatan peptida dalam
protein tersebut tidak sepenuhnya dapat diakses oleh enzim untuk diserang.
Reaksi ini juga lambat karena dilakukan pada suhu yang lebih rendah yang dapat
ditoleransi oleh enzim.
Protein
yang digunakan dalam makanan dihidrolisis secara enzimatik untuk meningkatkan
fungsionalitasnya. Fungsionalitas dapat diubah oleh berbagai jenis enzim,
tetapi sebagian besar menggunakan protease (Adler-Nissen, 1976). Tingkat
proteolisis tidak hanya bergantung pada struktur primer protein, tetapi juga
pada struktur sekunder dan tersier. Lipatan protein dalam beberapa sistem dapat
mengurangi aksesibilitas ikatan tertentu, yang dapat dengan mudah terbelah
ketika rantai diuraikan. Hidrolisis rantai insulin, misalnya, terutama
melibatkan struktur primer, dan oleh karena itu tergantung terutama pada sifat
kinetik protease (Ronca et al., 1975). Pencernaan miosin oleh tripsin
mengakibatkan pemotongan hanya 59% dari ikatan yang rentan, menunjukkan bahwa
inti protein tahan atau dicerna dengan sangat lambat (Mihalyi dan Harrington,
1959). Jika suatu protein sangat tidak larut karena struktur globularnya,
ikatan peptida dapat terbelah dengan kecepatan lambat sampai bagian dalam
molekul protein menjadi dapat diakses oleh enzim melalui pemotongan sebelumnya.
Hidrolisis
protein kedelai oleh Penicillium duponti (Constantinides dan
Adu-Amankwa, 1980) melibatkan pemotongan protein yang tidak larut dan agregat
yang sebagian larut. Polipeptida yang sebagian larut dihidrolisis dalam reaksi
cepat menjadi peptida-peptida larut yang lebih kecil, sedangkan inti protein
yang lebih padat terlarutkan oleh enzim yang terserap dalam reaksi yang lebih
lambat.
Kecepatan
produksi protein kedelai yang larut mulai berkurang. Namun, konsentrasi
substrat masih cukup tinggi untuk menghindari kehabisan substrat. Pelarutan
tidak meningkat secara signifikan dengan penambahan enzim lebih lanjut, tetapi
meningkat jika larutan penyangga dihilangkan, dan hidrolisis dilanjutkan dengan
mengaduk kembali zat padat. Efek ini dapat disebabkan oleh adanya hambatan
produk (Constantinides dan Adu-Amankwa, 1980).
Mekanisme
Linderstrom-Lang
mengusulkan bahwa hidrolisis protein dapat dijelaskan dengan dua jenis urutan
reaksi. Ini disebut mekanisme "satu per satu" dan "zipper".
Gambar 1 menunjukkan ide dasar di balik kedua mekanisme ini (Adler-Nissen,
1976).
Reaksi
"satu per satu" disebut demikian karena enzim menghidrolisis satu
rantai pada satu waktu. Ini akan terjadi jika aksesibilitas ikatan meningkat
seiring dengan proses pemotongan. Jika langkah "denaturasi" pertama,
yang direpresentasikan sebagai langkah yang dapat terbalik dalam Gambar 1,
menentukan laju reaksi, maka hanya protein asli dan produk akhir yang
terdeteksi (Adler-Nissen, 1985).
Gambar 1. Model satu
per satu dan tipe zipper oleh Linderstrom-Lang. Protein asli ditandai dengan
lingkaran, protein terdenaturasi dengan persegi panjang, peptida dengan persegi
panjang kecil yang berbeda panjangnya sesuai dengan panjang rantai. Bulan sabit
melambangkan serangan enzimatik (Adler-Nissen, 1976).
Sebaliknya,
reaksi "zipper" terjadi ketika protein asli mudah terdenaturasi dan
sejumlah besar ikatan terbuka. Enzim dapat memotong pada beberapa situs yang
berbeda, tetapi jika laju pemotongan lambat, akan terjadi penumpukan produk
intermediate, karena produk akhir terbentuk dengan lambat.
Sebagian
besar reaksi hidrolisis akan menjadi kombinasi dari kedua mekanisme tersebut.
Satu mekanisme mungkin lebih disukai daripada yang lain tergantung pada sifat
dan konsentrasi substrat dan enzim; pH dan suhu juga dapat memainkan peran
(Adler-Nissen, 1976).
Penggunaan
hidrolisat
Dalam
hidrolisis enzimatik, masalah utama adalah hidrolisis berlebihan yang
mengakibatkan pembentukan "peptida pahit". Rasa pahit tidak dapat
diterima jika hidrolisat tersebut digunakan dalam makanan. Peptida pahit dapat
dihindari dengan mengendalikan tingkat hidrolisis dan dengan demikian
mengurangi pembentukan peptida berbobot molekul rendah.
Gelatin
dan albumin telur digunakan sebagai agen pengembang dalam makanan penutup,
tetapi tidak digunakan untuk memberikan rasa karena hidrolisat ini memiliki
rasa yang relatif hambar (Prendergast, 1974).
Protein
kedelai digunakan sebagai bahan dalam makanan dengan pH rendah, tetapi harus
dibuat lebih enak dan profil kelarutannya harus ditingkatkan. Akibat tingkat
hidrolisis sebesar 10%, protein kedelai telah larut sebesar 65-75% pada pH 8
dan suhu 50°C (Olsen dan Adler-Nissen, 1979b). Hidrolisat protein kedelai dapat
digunakan dalam minuman ringan untuk meningkatkan nilai gizinya (Adler-Nissen,
1977).
Aplikasi
makanan lainnya terdapat dalam bidang gangguan pencernaan, misalnya ketika
enzim pankreas tidak mencukupi. Hidrolisat enzimatik telah digunakan dalam
pengobatan fibrosis kistik. Protein disediakan dalam bentuk pra-dipecah karena
usus kecil terganggu. Contoh dari aplikasi tersebut adalah penggunaan susu skim
dan kasein (Clegg, 1977, Adler-Nissen, 1977).
Sebagai
konsekuensi dari aplikasi sukses beberapa hidrolisat makanan, ada motivasi
untuk menyelidiki sumber protein kaya lainnya, asalkan rasa pahit dapat
dihindari selama hidrolisis, misalnya hidrolisat protein ikan.
Hidrolisis
dari tepung gluten jagung, yaitu konsentrat protein jagung, merupakan sumber
protein yang baik, tetapi sifatnya tidak ideal untuk tujuan ini. Adler-Nissen
(1978a) melaporkan modifikasi yang berhasil dari tepung gluten jagung
menggunakan Alcalase 0.6L, tanpa menciptakan peptida pahit. Namun, hidrolisis
dilakukan hanya pada tepung gluten jagung dari satu pemasok. Oleh karena itu,
tidak dapat dikecualikan bahwa beberapa kesimpulan mungkin khusus untuk tepung
gluten jagung tertentu yang digunakan.
Konsentrasi
substrat tertinggi yang digunakan adalah 8% w/w protein karena peningkatan
viskositas yang besar (lebih dari sepuluh kali lipat) selama hidrolisis.
Konsentrasi protein yang lebih tinggi tidak dapat digunakan karena masalah
agitasi yang mungkin terjadi. Tidak ada laporan tentang penggunaan hidrolisat
sebagai tambahan protein dalam makanan.
Metode
Hidrolisis pH Stat
Prinsip
Derajat
hidrolisis, yang sebenarnya merupakan persentase ikatan peptida yang
terpecahkan, dapat diukur dengan memonitor penambahan basa yang diperlukan
untuk mempertahankan pH selama hidrolisis (Adler-Nissen, 1985). Grup karboksil
bebas dan gugus amino bebas dapat atau tidak dapat terionisasi, tergantung pada
pH dan sejauh mana suhu reaksi. Pada suhu 25°C, pK dari grup karboksil dalam
polipeptida berada antara 3,1 dan 3,6, dan pK dari gugus amino berada antara
7,5 dan 7,8 (Adler-Nissen, 1985). Jika reaksi berlangsung pada pH 8 dan suhu
25°C, grup karboksil akan sepenuhnya terdisosiasi dan gugus amino akan sebagian
terprotonasi (Eriksen, 1982a). Oleh karena itu, hidrolisis menghasilkan
pelepasan proton di mana stoikiometri tergantung pada tingkat protonasi gugus
amino α.
Derajat
protonasi dari gugus amino α dapat dinyatakan dalam hal pK dari gugus amino
pada pH dan suhu tertentu, serta pH sistem. Derajat disosiasi a meningkat
dengan meningkatnya suhu, pKa dari gugus amino pada pH 8 dan suhu 25°C adalah
7,7, tetapi pada suhu 50°C pKa turun menjadi 7,1 (Eriksen, 1982a, Adler-Nissen,
1982).
Sebuah
protein terdiri dari sejumlah ikatan peptida yang secara teoritis dapat
semuanya terpecahkan untuk memberikan derajat hidrolisis 100%. Jumlah total
ikatan peptida dalam protein tertentu dapat dihitung dari komposisi asam amino
dalam mmol dari masing-masing asam amino per g protein (Adler-Nissen, 1985).
Jumlah total ikatan peptida ditandai dengan htot.
Alat
pH stat digunakan untuk menentukan jumlah sebenarnya dari ikatan peptida per g
yang terpecahkan selama hidrolisis.
Ketika
hidrolisis dilakukan pada kondisi netral atau sedikit basa, derajat hidrolisis
(DH) dapat terus dipantau. Tanpa menggunakan teknik pH stat, pH akan turun
seiring dengan berjalannya hidrolisis, seperti yang ditunjukkan dalam persamaan
(2). Teknik pH stat melibatkan penambahan basa, seperti natrium hidroksida,
untuk menjaga pH tetap konstan. Konsumsi basa adalah sebanding dengan ekuivalen
hidrolisis, h. Nilai h diberikan oleh persamaan (Eriksen, 1982b):
h =
B x Nb x (-1)^(1/a) x (-MP)
Di
mana:
h
adalah ekuivalen hidrolisis,
B
adalah jumlah basa yang dikonsumsi (dalam mmol),
Nb
adalah normalitas basa,
a
adalah derajat protonasi gugus amino α,
MP
adalah massa protein yang terhidrolisis.
Dengan
menggunakan teknik pH stat dan memantau konsumsi basa, kita dapat menghitung
ekuivalen hidrolisis dan memonitor kemajuan hidrolisis secara langsung. Hal ini
memungkinkan pengendalian proses hidrolisis untuk mendapatkan derajat
hidrolisis yang diinginkan dalam kondisi yang diinginkan.
Cara
Penggunaan
pH
stat meter membutuhkan elektroda pH yang dicelupkan ke dalam sistem reaksi.
Elektroda pH terhubung ke pengukur pH, yang pada gilirannya terhubung ke
pengontrol yang dapat diatur.
Buret
yang digerakkan oleh motor bertanggung jawab untuk pengiriman titran, baik asam
maupun basa. Salah satu ujung buret juga harus dicelupkan ke dalam sistem
reaksi. Pengontrol dapat diatur untuk menjaga nilai pH tertentu. Jika pH
menyimpang dari nilai yang diinginkan, titran ditambahkan hingga pH asli
dipulihkan (Jacobsen et al., 1957). Konsumsi basa dapat dicatat dengan waktu
menggunakan perekam.
Pengontrol
memulai buret yang digerakkan oleh motor ketika potensial keluaran dari
pengukur pH menyimpang dari nilai yang diinginkan. Pengontrol berhenti ketika
pH kembali ke nilai aslinya.
Pengontrol
ini merupakan pengontrol proporsional. Keuntungan dari ini adalah bahwa di
dekat titik set, jumlah titran yang ditambahkan lebih sedikit, dan penambahan
berhenti ketika titik set tercapai.
Karbondioksida
dari atmosfer dapat memperkenalkan beberapa kesalahan dalam pengukuran derajat
hidrolisis ketika pH stat beroperasi pada pH basa. Adler-Nissen (1985)
menunjukkan bahwa, untuk muatan 1 liter yang beroperasi pada pH 9 dan 50°C,
kurang dari 0,08 mol karbondioksida diserap selama eksperimen empat jam. Oleh
karena itu, diasumsikan bahwa penyerapan karbondioksida diabaikan dibandingkan
dengan jumlah titran yang dikonsumsi selama hidrolisis. Penyerapan
karbondioksida dapat dihindari jika gas inert seperti nitrogen dialirkan
melalui sistem.
Model Hidrolisis
Pendekatan
Michaelis-Menten dalam kinetika enzim telah banyak digunakan. Konstanta kinetik
dalam percobaan hidrolisis protein pangan dievaluasi menggunakan pendekatan
yang berbeda untuk sistem enzim larut dan substrat tidak larut.
Sebuah
model kinetik menyediakan pemahaman mekanistik tentang hidrolisis enzimatik.
Dengan substrat makromolekul, model lengkap dari sistem dapat menjadi sangat
kompleks. Dalam kebanyakan kasus, beberapa asumsi yang valid akan menghasilkan
model yang lebih dapat dikelola, namun masih mewakili mekanisme dengan memadai
untuk tujuan desain reaktor.
Sebuah
model statistik yang menggunakan persamaan laju empiris juga dapat diterapkan
pada isolat kedelai. Meskipun informasi tentang mekanisme hilang, presisi
sangat baik untuk optimasi dan desain proses hidrolisis.
Model-model
Kinetik
Berbagai
model kinetik telah diterapkan pada sistem enzim larut dan substrat tidak
larut. Hidrolisis enzimatik protein kedelai (Constantinides dan Adu-Amankwa,
1980) dan protein daging tanpa lemak (O'Meara dan Munro, 1985) dimodelkan menggunakan
model hambatan produk Michaelis-Menten. Sebagai alternatif, penyerapan enzim
pada substrat (metode penyerapan Freundlich) diikuti oleh hidrolisis berikutnya
digunakan untuk memodelkan hidrolisis enzimatik hidrolisat protein ikan (Archer
et al., 1973). Hidrolisis rantai teroksidasi dari insulin A dan B dimodelkan
sebagai dua reaksi paralel simultan (Montali et al., 1980). Tidak jelas model
kinetik mana yang mungkin sesuai dengan data eksperimental sampai sistem
tersebut diteliti secara teliti.
Model
Michaelis-Menten
Sistem
substrat tidak larut dapat dimodelkan menggunakan mekanisme yang serupa dengan
yang digunakan untuk hidrolisis substrat larut.
Model
yang digunakan oleh Constantinides dan Adu-Amankwa (1980) memodifikasi
persamaan Michaelis-Menten untuk memperhitungkan hambatan produk dan dapat
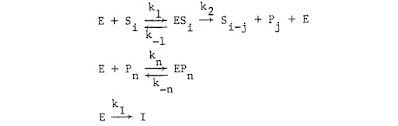
direpresentasikan oleh mekanisme berikut:
Persamaan (7) mewakili proses multi-langkah di mana intermediat S dihasilkan dan terdegradasi lebih lanjut. Persamaan (8) mewakili hambatan produk, di mana sebagian produk secara kompetitif mengikat enzim. Persamaan (9) mewakili inaktivasi enzim. Si-j mewakili semua "intermediat", dengan berbagai berat molekul, dalam hidrolisis. Dengan cara yang sama, p mewakili sekelompok peptida berat molekul yang lebih kecil namun bervariasi.
Model
mekanistik serupa digunakan untuk hidrolisis enzimatik protein daging tanpa
lemak yang tidak larut menggunakan protease Alcalase 0.6L (O'Meara dan Munro,
1985) dan juga hidrolisis selulosa oleh Trichoderma viride (Howell dan Stuck,
1975).
Model
adsorpsi Freundlich
Model
kinetik ini pertama-tama mempertimbangkan penyerapan enzim pada substrat yang
tidak larut, yang dievaluasi menggunakan isoterma adsorpsi Freundlich.
Penyerapan enzim kemudian digabungkan dengan ekspresi kinetik untuk hidrolisis.
Hidrolisis enzimatik konsentrat protein ikan, pati, dan selulosa (Archer et
al., 1973, McLaren, 1963) semuanya telah dimodelkan dengan cara ini.
Reaksi
simultan orde pertama
Metode
alternatif yang diterapkan pada hidrolisis rantai teroksidasi insulin A dan B
adalah dengan mempertimbangkan dua reaksi simultan orde pertama (Mihalyi dan
Harrington, 1959, Ronca et al., 1975). Enzim subtilisin Carlsberg digunakan
untuk hidrolisis ini; enzim ini memiliki spesifisitas yang sangat luas.
Kinetika reaksi tersebut diikuti menggunakan teknik pH stat, yang sayangnya
tidak dapat mendeteksi reaksi terpisah. Oleh karena itu, jumlah kedua reaksi
seiring waktu diukur. Adanya dua reaksi simultan diidentifikasi melalui
analisis kinetik.
Dua
reaksi simultan terdiri dari reaksi cepat dan reaksi lambat, di mana
proteolisis ikatan peptida satu kelas adalah reaksi yang cepat. Ikatan ini
diidentifikasi sebagai CyS(03H)-Ser dan Leu-Tyr. Kelas ikatan
lainnya dipotong lebih lambat sesuai dengan reaksi orde pertama. Situs pemotongan
dalam kasus ini adalah Leu-Glu, Asn-Tyr, dan Try-Cys(03H) (Montali
et al., 1980). Ikatan yang dipotong secara lambat lainnya juga diidentifikasi
sebagai Glu-Gln (Ronca et al., 1975). Ronca et al. (1975) menyatakan bahwa
proteolisis terbatas pada situs lain juga mungkin terjadi, karena spesifisitas
yang luas dari subtilisin Carlsberg.
Konstanta
laju dievaluasi dengan memplotkan logaritma alami laju proteolisis terhadap
waktu. Laju proteolisis dinyatakan sebagai laju konsumsi basa (dP/dt) yang
diukur oleh pH stat. Umumnya disimpulkan bahwa reaksi cepat selesai sebelum
sebagian besar reaksi lambat terjadi secara signifikan (Mihalyi dan Harrington,
1959).
Model
statistik
Model
statistik (Adler-Nissen, 1985) tidak memberikan informasi tentang mekanisme
hidrolisis, tetapi digunakan sebagai perbandingan empiris antara kurva
hidrolisis untuk tujuan optimasi proses. Model statistik membandingkan kurva
hidrolisis eksperimental dengan kurva hidrolisis standar yang telah ditentukan.
Faktor skala digunakan untuk mengkoreksi skala waktu untuk setiap perbedaan
antara kurva eksperimental dan kurva standar. Perbedaan antara kurva dapat
disebabkan oleh suhu hidrolisis yang berbeda atau konsentrasi enzim yang berbeda,
misalnya. Teknik statistik digunakan untuk membandingkan kurva hidrolisis,
karena kesalahan eksperimental serta kondisi reaksi akan menyebabkan perbedaan
antara kedua kurva hidrolisis.
Model
analisis statistik mengandalkan fakta bahwa hanya satu enzim yang hadir, dan
konsentrasi substrat cukup tinggi untuk memastikan bahwa enzim jenuh dengan
substrat sepanjang hidrolisis (Adler-Nissen, 1985).
Model
ini telah diterapkan pada hidrolisis isolat kedelai menggunakan Alcalase.
Namun, model ini tidak dapat diterapkan pada tepung gluten jagung, di mana
enzim mungkin tidak jenuh dengan substrat sepanjang hidrolisis. Karena itu,
penerapan model ini tidak dilanjutkan.


Posting Komentar untuk "Tinjauan Pustaka mengenai Hidrolisis Protein"